来源:经济网 作者: 2022-02-22 15:41:51
当前,心血管代谢性疾病已经成为威胁人类健康的第一杀手,据统计,我国心血管疾病患者高达3.3亿人、代谢性疾病患者约4.5亿人,其发病率仍持续上升,成为严重威胁人民健康的重大公共卫生问题。有效防治此类疾病的关键是全面而深入认识和解析其病理生理学及分子生物学机制,并在此基础上开发相关药物等防治和诊疗策略。
武汉大学李红良团队始终聚焦于心血管及代谢性疾病领域的重大问题,探索该领域重大疾病的重要分子生物学机制,并开展转化研究、药物开发和临床研究。该团队近年来在该领域,特别是在非酒精性脂肪肝病(NAFLD)及其相关疾病研究领域不断取得重大突破和重要成果,累计在Nature Medicine、Cell Metabolism、Circulation、Science Translational Medicine、Journal of Hepatology、Circulation Research、Hepatology 等一流期刊发表研究论文200多篇。
2021年,我们关注到 李红良团队共发表29项重要的研究成果,其中SCI影响因子高于10的有15篇,高于20的有5篇。 2021年,李红良团队研究领域涵盖了心血管疾病、代谢性疾病和新冠肺炎临床大数据研究等领域,阐明了一系列心脏疾病、脂肪肝炎、缺血再灌注损伤等临床重大疾病的重要发病机制,发现了一批关键作用靶点,研发出一系列小分子先导药物。为认识心血管代谢性疾病提供了新的重要理论基础,也为该领域新药开发提供了一系列新的思路及潜在靶点。
iNature按照领域系统总结了其中的主要研究成果:
研发全新心血管代谢性疾病创新治疗药物
心血管代谢性疾病已成为导致人类死亡的头号杀手。为了解决心血管代谢性疾病的发病机制和临床治疗问题,李红良教授团队近十多年来综合运用生物大数据、疾病动物模型、人工智能药物设计等前沿技术,发现花生四烯酸通路是心脏、肝脏缺血再灌注损伤和脂肪肝炎的核心发病机制,并进一步找到了最关键的治疗靶点—12-脂氧合酶(ALOX12)。根据这一重要靶点,研究团队开发出了3种高效安全的先导化合物,其中一种全新的小分子化合物(IMA-1)可精准靶向ALOX12-ACC1蛋白相互作用,显着抑制小鼠和食蟹猴脂肪肝炎发生发展。更为重要的是,这一新开发的先导化合物不会引起高血脂等副作用。系列研究突破性解决了靶向ACC的副作用问题,破解了靶向ACC治疗脂肪肝炎的困境。系列成果于2021年12月15日作为封面文章在《科学•转化医学》杂志背靠背同时发表,并被列为亮点研究写入12月17日出版的《科学》杂志特刊。 同时,科研团队还首次发现ALOX12小分子抑制剂ML355可有效改善小鼠、巴马猪和恒河猴的心脏缺血再灌注损伤,显着提升心功能,为深入探索心脏缺血再灌注损伤、改善心梗患者预后、提高患者生存率提供了重要支撑。
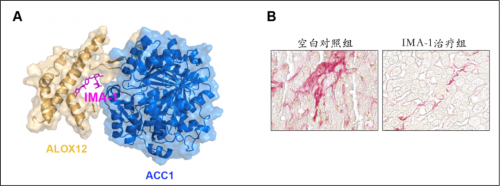
图A. IMA-1抑制ALOX12和ACC1蛋白互作结构图;图B. IMA-1治疗脂肪肝炎效果(红色染色区域代表肝脏纤维化程度)
发现系列代谢性疾病重要机制和关键靶点
肥胖、2 型糖尿病以及 NAFLD 是代谢综合征的主要诱因,为了更好地解决这些健康威胁,李红良教授团队对疾病发病机制进行了深入探索。采用大规模系统生物学筛选分析、免疫荧光、过表达腺病毒处理等先进技术,研究团队发现TMBIM1是通过降低PPARγ的稳定性而抑制脂肪生成,是一种有效抑制脂肪生成的全新因子 ,为加深脂肪生成调控机制的认识提供了潜在分子靶点与新思路;发现Nemo样激酶(NLK)作为一种新型肝糖异生负调控因子 ,促进CRTC2和FOXO1核输出,在糖异生调节网络中起着关键作用,NLK可能成为2型糖尿病的潜在治疗靶点 ;为了进一步阐明NAFLD的发病机制,研究团队还发现了一系列重要分子,如MAVS、SNX8、RNF5、RGS5等,它们都是NAFLD发展的关键分子,是NAFLD预防和治疗的潜在药物靶点。系列研究成果发表在Cell Metabolism、Hepatology等国际权威杂志。
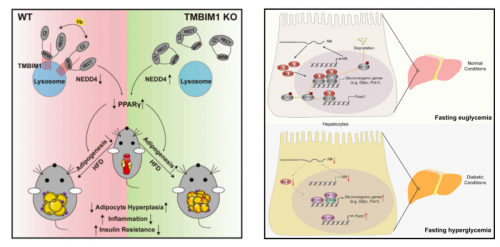
图左:TMBIM1调控脂肪生成新机制 图右:NLK促进CRTC2和FOXO1核输出
研究心血管疾病危险驱动因素
心血管疾病已成为全球死亡率增加的主要原因。近年来,随着社会的发展、人民生活水平的提高以及生活方式的改变,代谢危险因素已成为心血管疾病发病率逐年上升的重要原因。李红良教授团队通过应用全球疾病负担研究的方法框架,分析了1990年至2019年全球缺血性心脏病疾病负担和15个相关的一般危险因素,发现代谢危险因素已成为缺血性心脏病的主要驱动因素 ,并为不同国家及地区缺血性心脏病防治政策的制定提供了有力依据。此外,研究团队还发表了相关综述总结了代谢因素驱动多种心血管疾病发展的流行病学趋势和病理生理机制等。系列研究成果发表在Cell Metabolism、Cir Res 等国际权威杂志。
解决新冠用药难题、开发风险评估工具
新冠病毒仍在威胁全球人类健康。在最初的新冠患者治疗过程中,激素应该如何使用一直是个颇具争议的问题。为了破解这个难题,李红良教授团队通过建立新冠住院患者数据库,开展新冠患者回顾性和多中心队列研究,发现新冠患者入院时嗜中性粒细胞与淋巴细胞比值(NLR)> 6.11的患者,使用皮质类固醇激素能够降低他们的死亡风险。因此,该研究首次明确了新冠肺炎治疗中糖皮质激素用药的边界,提出NLR可作为新冠患者是否需要接受激素疗法的判断标准。 此外,研究团队还开发了两种临床适用的新冠风险评估工具(OURMAPCN 评分和PAWNN 评分),根据有限数量的临床参数来识别具有较高死亡风险的新冠患者。这些易于实施的风险评估工具能够帮助临床医生及时判断病人风险动态变化,及时调整救治方案并优化医疗资源分配。系列研究成果发表在Cell Metabolism、Med(N Y) 等国际权威杂志。
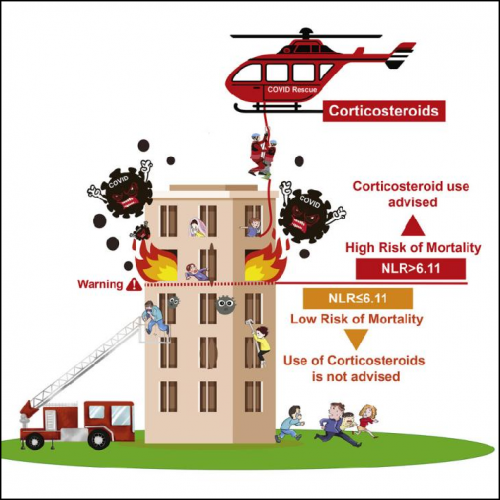
新冠肺炎治疗中糖皮质激素用药的边界
绿色人才助力365bet体育在线官_365bet开户网_最大365买球网国际化走向深 ...